Rilevatori di fumo, terapia per il cancro, sonde spaziali… sono solo alcune delle conquiste che derivano dalla nostra conoscenza della struttura dell’atomo.
Ma persino oggi, dopo 100 anni dalla sua scoperta, il nucleo atomico può ancora sorprenderci. Scopriamo come.
1. L'atomo e i primi esperimenti sul nucleo atomico

Gli antichi greci credevano che l’atomo fosse indivisibile, e questa convinzione è rimasta tale fino a 100 anni fa, quando l’ingegnoso fisico britannico Ernest Rutherford vi ha posto definitivamente fine, con il suo articolo rivoluzionario pubblicato sulla rivista scientifica Philosophical Magazine.
Nell’articolo Rutherford rivelò che la struttura dell’atomo doveva essere formata da un nucleo, piccolo e compatto, e da particelle, gli elettroni, che gli orbitavano intorno.
Per il resto, l’atomo non doveva essere altro che spazio vuoto.
Nei primi del ’900 la teoria più popolare riguardo la struttura dell’atomo era quella cosiddetta del Raisin Bun Model (teoria del modello a panettone) sostenuta dal fisico Joseph John Thomson, il quale nel 1897 scoprì che gli atomi contengono minuscole particelle caricate negativamente, già conosciute come elettroni (nome inventato nel 1884 da Stoney).
Doveva comunque esistere una carica positiva per poter neutralizzare la carica negativa degli elettroni, e Thomson suppose che questa fosse distribuita uniformemente su tutto l’atomo, sul quale gli elettroni erano sparpagliati, appunto, come l’uvetta nel panetone.
Rutherford basò la sua nuova teoria atomica su diversi esperimenti, effettuati negli anni precedenti dai suoi colleghi Hans Wilhelm Geiger e Ernest Marsden, e da lui stesso incoraggiati.
I ricercatori, per studiare la struttura dell’atomo, bombardarono una lamina sottile di metallo con particelle alfa provenienti dal radio, e con loro grande sorpresa, alcune particelle rimbalzarono verso il punto di emissione.
L’esperimento non era spiegabile con il modello di Thomson. Le particelle alfa, molto energetiche, non avrebbero potuto subire che piccole deviazioni della traiettoria a causa degli elettroni e della carica positiva distribuita in tutto l’atomo.
“Fu come lanciare una palla di cannone contro un foglio di carta velina e vederla rimbalzare indietro”, disse Ernest Rutherford.
Soltanto un nucleo atomico costituito dalla maggior parte della massa dell’atomo, concentrato in un luogo di piccolissime dimensioni, poteva spiegare una tale reazione da parte delle particelle alfa.
A questo punto bisognava cercare la spiegazione di come gli elettroni mantenessero orbite stabili intorno al nucleo. Il problema fu risolto dal fisico danese Niels Bohr, con il suo collegamento del modello atomico di Rutherford alla meccanica quantistica.
Bohr introdusse così il suo modello, secondo cui gli elettroni non possono trovarsi che a distanze fissate dal nucleo atomico, in corrispondenza di diversi livelli energetici, i cosiddetti stati stazionari.
2. Le particelle vengono scoperte una dopo l'altra
Rutherford continuò i suoi esperimenti sul nucleo atomico, utilizzando particelle alfa provenienti da elementi radioattivi, e nel 1919 scoprì che bombardando l’azoto con particelle alfa si ottenevano nuclei di idrogeno.
Questo gli fece concludere che i nuclei atomici contengono particelle elementari identiche ai nuclei di idrogeno.
Così furono identificati i protoni, ma tenuto conto della carica, il nucleo atomico era troppo pesante per essere composto di soli protoni.
Ci doveva quindi essere un’altra particella nucleare priva di carica elettrica. Fu trovata nel 1932, quando venne dimostrata l’esistenza dei neutroni.
A questo punto, l’atomo veniva raffigurato come formato da un nucleo compatto di protoni e neutroni, circondato da un’orbita di elettroni.
Ma era difficile spiegare come il nucleo atomico non venisse distrutto dalle ingenti forze elettromagnetiche che si stabiliscono tra le cariche positive dei protoni.
Ci doveva essere una forza naturale che vincolava le particelle fra loro: la cosiddetta forza nucleare forte. Fu tuttavia solo alla metà degli anni ’60 che fisici teorici pensarono a qualcosa che potesse spiegare la stabilità del nucleo atomico.
Immaginarono che protoni e neutroni fossero particelle complesse, costituite da tre particelle elementari, che furono chiamate quark. Questi erano tenuti insieme da particelle che “trasportano” la forza, dette gluoni (dall’inglese glue = colla).
L’interazione tra queste particelle elementari è descritta da una teoria detta cromodinamica quantistica, secondo la quale i gluoni legano i quark di un protone o un neutrone con forza tale che non possono essere separati. E in effetti, gli scienziati non hanno mai osservato un quark isolato.
3. I fisici hanno fuso i nuclei

Per mezzo di acceleratori di particelle è possibile compiere esperimenti che confermano la teoria.
Protoni e neutroni sono effettivamente composti da quark di dimensioni talmente ridotte da potersi considerare puntiformi.
Per mezzo dei più potenti acceleratori si può persino trasformare lo stato fisico dei nuclei atomici. Quando un nucleo viene scaldato fino a duemila miliardi di gradi, “fonde” e si trasforma in un plasma di quark e gluoni in continua interazione.
Nella prima frazione di secondo dopo il Big Bang, la materia dell’universo deve essere stata simile a questo “liquido”, un brodo primordiale di particelle elementari che, dopo essersi raffreddate, avrebbero iniziato ad aggregarsi in protoni e neutroni,dando vita così alla formazione degli elementi più leggeri.
La potente forza che tiene insieme i quark ha l’effetto secondario di unire protoni e neutroni gli uni con gli altri all’interno del nucleo. La forza che ne deriva ha una portata molto corta, e i protoni e i neutroni non sono abbastanza vicini da reagire tra loro.
Era esattamente la conversione spontanea di un nucleo atomico instabile, il decadimento radioattivo, che Rutherford utilizzò nei suoi esperimenti con le radiazioni alfa. In seguito risultò che esistono numerose applicazioni pratiche.
L’energia proveniente dalla radioattività naturale può essere trasformata in elettricità, e permette la costruzione di batterie a lunga vita , con applicazioni in vari campi, tra cui sonde spaziali e pacemaker.
Elementi nucleari vengono utilizzati con successo in vari campi: dai rilevatori di fumo alla medicina diagnostica; e anche nella terapia di varie malattie, tra cui il cancro della prostata.
4. Energia controllata nelle centrali elettriche

Le reazioni nucleari possono anche essere provocate volontariamente.
Dalla scissione del nucleo atomico viene prodotta energia in quantità elevatissima, dalle potenzialità infinite: dalle centrali elettriche alle bombe atomiche.
Con gli elementi leggeri avviene il contrario. L’energia si sprigiona quando si ha la fusione di più nuclei, come succede ad esempio nel processo di fusione di nuclei di idrogeno in elio nelle stelle.
L’energia rilasciata dalla fusione del nucleo di idrogeno è anche quella che fornisce alle bombe all’idrogeno la loro estrema potenza esplosiva, e gli scienziati sperano di essere in grado di controllare questa energia nelle future centrali elettriche.
Ma per dare inizio alla fusione occorrono temperature estremamente alte. Mentre i tecnici cercano di trovare i metodi per utilizzare i nuclei atomici come fonti di energia, altri scienziati cercano di avere una miglior comprensione del nucleo atomico.
C’è ancora molto che non sappiamo, come ad esempio il modo in cui sono disposte le particelle al suo interno. Nessun microscopio può vedere un nucleo atomico.
Esattamente come Rutherford ed i suoi colleghi fecero 100 anni fa, i fisici moderni bombardano i nuclei atomici con particelle ad alta energia, per studiarli più da vicino; l’unica differenza è che utilizzano elettroni invece che particelle alfa.
Osservando la variazione delle traiettorie degli elettroni, carichi negativamente, quando si avvicinano al nucleo, carico positivamente, è possibile calcolare le dimensioni del nucleo.
Anche il protone è stato misurato e l’attuale valore ufficiale del suo raggio è di 0,8775 fm (poco meno di un centimiliardesimo di millimetro, ndr). Esperimenti recenti mostrano che il protone potrebbe essere più piccolo del 4% di quanto ritenuto fino ad oggi: è una differenza non trascurabile.
Se non si tratta di un errore di misura, siamo di fronte ad uno scenario completamente nuovo. Questo genere di esperimenti mostra che abbiamo ancora molto da imparare sul nucleo atomico.
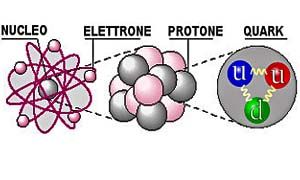
5. L'elemento base della materia
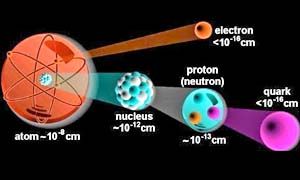
I primi segni che l'atomo non fosse indivisibile apparvero Intorno al 1900. Da allora i fisici hanno imparato moltissimo, e capito che anche lo stesso nucleo atomico è composto da parti più piccole.
- 1896: Henry Becquerel scopre per caso la radioattività naturale, quando trova alcune tracce su delle lastre fotografiche.
- 1897: il fisico britannico Sir Joseph John Thomson identifica la prima particella subatomica, l'elettrone, misurandone anche la massa.
- 1911: Ernest Rutherford scopre il nucleo atomico. Gran parte del suo lavoro avviene in un laboratorio rudimentale. In quest'anno un’ingegnosa invenzione ha reso molto più semplici la scoperta e lo studio di particelle subatomiche. La camera a nebbia è un cilindro di vetro contenente aria supersatura di vapore acqueo. Quando una particella elettricamente carica, come un nucleo atomico, sfreccia nella camera, interagisce con gli altri atomi ionizzandoli, facendo cioè acquisire loro una carica elettrica. L'acqua contenuta nell'aria si condensa intorno a questi atomi, lasciando una traccia inconfondibile.
- 1913: Niels Bohr presenta la sua teoria atomica, destinata ad avere un grande successo.
- 1919: Ernest Rutherford scopre il protone come particella nucleare fondamentale.
- 1932: James Chadwick prova l'esistenza del neutrone. È elettricamente neutro ed ha circa la stessa massa del protone.
- 1935: Hideki Yukawa suggerisce che le particelle nucleari siano tenute insieme da una forza naturale chiamata forza nucleare forte. La forza ha influenza solo nelle brevi distanze che esistono tra i nuclei atomici.
- 1945: l'energia dei nuclei atomici viene liberata con conseguenze letali. Due bombe nucleari vengono sganciate sul Giappone. La potenza distruttiva del nucleo atomico sorprende e spaventa molti scienziati.
- 1964: i fisici Murray Gell-Mann e George Zweig scoprono che le particelle nucleari sono composte da unita ancor più elementari, chiamate quark da Gell-Mann.
- 1968: viene provata l'esistenza dei quark per la prima volta, in un esperimento che viene effettuato nell'acceleratore di particelle dello Stanford Linear AcceleratorCenter,in California, lungo più di 3 km.
- 1979: esperimenti con gli acceleratori di particelle effettuati in Germania dimostrano l'esistenza dei gluoni, i mediatori dell'interazione forte, che "incollano"i quark fra loro.
- 1984: viene presentata la teoria delle superstringhe, che afferma che tutte le particelle e tutte le forze possono essere considerate come minuscole corde che vibrano in uno spazio-tempo multidimensionale.
- 2005: in un acceleratore di particelle americano nuclei di atomi di oro vengono fatti collidere con tale forza che si fondono tra loro, trasformandosi in plasma di quark e gluoni. Gli scienziati ipotizzano che un plasma molto simile probabilmente riempiva l'universo nei primi istanti successivi al Big Bang.
- 2010: viene determinata la misura di un protone per mezzo di un atomo di idrogeno muonico. Si scopre che il protone è di dimensioni inferiori a quanto si credesse: circa il 4 per cento in meno.
- 2011: calcoli precisi indicano che i nuclei atomici si trasformano in plasma di quark e gluoni alla temperatura di duemila miliardi di gradi, vale a dire la temperatura dell'universo durante i primissimi secondi di vita.
Note
- QUARK - Diametro di ogni quark: meno di 10-19 m. I quark sono talmente piccoli che possono essere considerati puntiformi.
- PROTONE/NEUTRONE - Diametro di ogni protone e neutrone: approssimativamente 2x10-15, cioè due centesimi di miliardesimo di millimetro.
- ATOMO - Diametro di un atomo di carbonio: 1,4x10-10 m. L'intero atomo è formato dal nucleo, più la nuvola di elettroni orbitanti. Se il nucleo atomico fosse di dimensioni uguali a quelle in figura, l'intero atomo avrebbe un diametro di circa 2 km; praticamente le dimensioni di una piccola città.
- NUCLEO - Diametro del nucleo: 5x10-15 m Massa del nucleo: 2x10-26 kg
Densità del nucleo: 200 million t/cm3. I cm3 di nuclei densamente compattati peserebbe quindi come 1.000 super petroliere.






