
Vista dallo Spazio profondo, la Terra è un puntino blu: il motivo è che oltre il 70 per cento della sua superficie è ricoperto d’acqua.
Questa sostanza si trova anche in altri pianeti (si ritiene, per esempio, che su diverse lune di Giove e di Saturno siano presenti risorse idriche importanti), ma il nostro è, senza alcun dubbio, l’unico mondo del Sistema Solare così caratterizzato dalla presenza di questo prezioso liquido.
È grazie all’acqua e alle sue proprietà uniche che la vita è nata sulla Terra. Per noi, però, è un sostanza tanto familiare che spesso ci dimentichiamo di quanto sia straordinaria.
L’acqua è una delle sostanze più miracolose, impareggiabile e preziose dell’Universo e per noi sarebbe impossibile farne a meno. Benvenuti nel suo meraviglioso mondo!
1. Che cos’è, esattamente e che cos’ha di tanto speciale?

- Che cos’è, esattamente?
La sua formula è H2O: è quindi una molecola semplice, che consiste in due atomi di idrogeno e uno di ossigeno.
È l’unica sostanza a esistere allo stato solido, liquido e gassoso alle temperature naturalmente riscontrabili sul nostro Pianeta.
È trasparente, ma non è interamente priva di colore: così come il cielo è azzurro perché le molecole atmosferiche tendono a diffondere la luce blu più di altri colori, anche le grandi masse d’acqua hanno una tinta simile, dagli oceani fino alle tenui sfumature dei ghiacciai (inoltre, mari e laghi riflettono l’azzurro del cielo, pertanto il loro colore risulta più intenso). - Che cos’ha di tanto speciale?
L’acqua è un eccezionale solvente, cioè, scioglie molto efficacemente altre sostanze.
È in parte per questo che è tanto preziosa per gli esseri viventi, in quanto agisce da vettore fluido per una grande varietà di sostanze chimiche presenti nelle cellule degli organismi.
Dà luogo tanto facilmente a soluzioni perché è in grado di aderire agli atomi delle sostanze, separandoli. Questo comportamento è il risultato di un legame a idrogeno (vedi il Glossario) particolarmente forte.
È proprio questo che rende l’acqua unica: l’attrazione elettrica tra atomi di idrogeno e altri atomi, per esempio di azoto, ossigeno e fluoro.
Il legame a idrogeno tra molecole dell’acqua stessa, inoltre, impedisce loro di separarsi facilmente, alzando il punto di ebollizione.
Se questo fenomeno non fosse presente, l’acqua bollirebbe a circa -70°C, e di conseguenza non sarebbe presente in forma liquida sulla Terra e non esisterebbero forme di vita.
Un altro importante effetto collaterale del ponte a idrogeno è il fatto che, quando l’acqua congela, i legami intermolecolari danno origine alle forme caratteristiche dei cristalli: per questo, i fiocchi di neve hanno sei punte e gli spazi all’interno del reticolo cristallino sono maggiori di quanto sarebbe possibile altrimenti.
I cristalli formano angoli tetraedrici (con quattro lati triangolari), e di conseguenza l’acqua allo stato solido (il ghiaccio) ha una densità inferiore rispetto alla sua forma liquida.
È il motivo per cui non è consigliabile riempire d’acqua una bottiglia e metterla in freezer, in quanto il contenuto, espandendosi, può rompere il vetro ed è per questo che il ghiaccio, sulla superficie di un lago, galleggia.
Si dice spesso che questa proprietà sia tipica dell’acqua: in realtà, anche l’acido acetico e il silicio, per esempio, sono meno densi allo stato solido rispetto a quello liquido.
Ma è vero che si tratta di una caratteristica molto rara.
2. Dove è stata trovata l’acqua nell’Universo e come facciamo a sapere che, in mondi tanto lontani, è presente l’acqua?

- Dove è stata trovata l’acqua nell’Universo?
Gli elementi chimici di base (idrogeno e ossigeno) sono molto comuni: sono addirittura il primo e il terzo per diffusione nell’Universo, in termini di massa.
Perciò, non sorprende che l’acqua si trovi un po’ ovunque: ogni pianeta del Sistema Solare ne contiene almeno un po’, anche se l’atmosfera torrida di Venere consente la presenza soltanto di piccole quantità di vapore.
Anche alcune lune ne sono ben fornite: la Luna terrestre sembra contenere depositi di ghiaccio, mentre si ritiene che alcuni satelliti naturali di Giove e Saturno, quali Europa, Ganimede, Callisto e Encelado, nascondano masse d’acqua salata sotto lo strato gelato superficiale.
Le comete, che dalla periferia del nostro Sistema Solare si dirigono verso il Sole, solitamente contengono grandi quantità di ghiaccio.
Spingendoci ancora oltre verso l’esterno, troviamo acqua nelle grandi nubi interstellari, nell’atmosfera di pianeti di lontani sistemi solari e nei dischi rotanti di materia dove hanno origine nuove stelle.
L’acqua, dunque, è davvero una sostanza molto diffusa: anche se raramente domina un ambiente tanto quanto accade sulla Terra. - Come facciamo a sapere che, in mondi tanto lontani, è presente l’acqua?
Non possiamo certo verificare di persona, ma gli astronomi hanno ideato sistemi per rilevare molecole nello Spazio.
Questi si basano sulla spettroscopia, ovvero lo studio dello spettro luminoso: quando la luce attraversa un materiale, parte delle lunghezze d’onda vengono assorbite, lasciando sullo spettro linee scure.
La spettroscopia è stata inizialmente utilizzata in astronomia per lo studio delle stelle, ma oggi viene diffusamente applicata al passaggio, per esempio, della luce attraverso una nube di materia nello Spazio profondo.
Composti diversi si caratterizzano per “spettri di assorbimento” esclusivi, vere e proprie impronte digitali di molecole specifiche.
Esistono addirittura distinzioni tra gli spettri dell’acqua allo stato liquido e del vapore acqueo (anche se al momento, la forma liquida non è rilevabile su distanze interplanetarie, a meno che non sia possibile osservarla direttamente).
Accertare la presenza di vapore acqueo nell’atmosfera di un pianeta che orbita intorno a una stella remota è più difficile che individuare molecole d’acqua isolate nello Spazio, perché il segnale emesso è difficile da distinguere dallo spettro proprio del corpo celeste.
Tuttavia, è attualmente in fase sperimentale, nel quadro del progetto europeo HotMol, una nuova tecnica, che combina la spettroscopia con informazioni sulla polarizzazione luminosa e che può fornire indicazioni sulla sorgente dello spettro.
La tecnologia offre ogni giorno nuove opportunità per determinare con esattezza la presenza di acqua nell’Universo.
3. L’acqua è essenziale per la vita e quanta acqua contiene il nostro corpo?
- L’acqua è essenziale per la vita?
Lo è certamente per gli esseri viventi del nostro Pianeta, che grazie a questa sostanza svolgono le proprie funzioni vitali.
Forme di vita sono state individuate in tutti gli ambienti della Terra, compresi i più ostili: organismi adattabili a temperature calde e fredde estreme e perfino all’assenza di aria.
Ogni essere vivente scoperto fino a oggi, tuttavia, contiene cellule che hanno bisogno di acqua: senza questo prezioso liquido, le cellule, semplicemente, non “funzionano”.
Oltre a garantire l’irrinunciabile idratazione e a fungere da veicolo per le sostanze chimiche, l’acqua è essenziale per i minuscoli, complessi meccanismi contenuti nell’ambiente cellulare.
Molti di essi si attivano grazie a specifiche sezioni molecolari che interagiscono con l’acqua, oppure che, al contrario, non si miscelano ad essa.
Le proteine, per esempio, sono le fondamentali molecole “operaie” degli organismi viventi: si dispongono secondo forme particolari per svolgere diversi ruoli, ed è proprio l’interazione con l’acqua di varie parti di una proteina a determinare tali conformazioni.
Questo liquido, pertanto, non è soltanto un solvente: è profondamente coinvolto nel funzionamento della straordinaria macchina cellulare. - Quanta acqua contiene il nostro corpo?
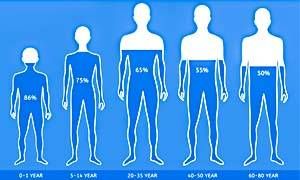
Siamo fatti, in gran parte, di acqua: generalmente tra il 50 il 70 per cento del peso corporeo.
La maggioranza di questo volume è contenuto nei circa 30 trilioni di cellule che costituiscono il nostro organismo, mentre il resto si trova nei fluidi organici, come il sangue.
L’acqua impedisce alle cellule di collassare e, inoltre, sempre a livello cellulare, funge da vettore per il trasporto delle varie molecole.
Quest’ultimo ruolo è particolarmente evidente nei flussi in movimento: per esempio, all’interno della circolazione ematica che veicola sostanze ai vari organi.
Altre funzioni sono la lubrificazione, la dissoluzione di diverse sostanze chimiche e l’ammortizzazione degli impatti diretti agli organi.
È difficile trovare una parte del corpo che non tragga vantaggio dalla presenza di acqua: perfino il tessuto osseo ne è costituito per un terzo.
Per inciso, se è vero che dobbiamo assumerne fino a due litri al giorno (circa otto bicchieri), ciò non significa che è necessario berla in forma pura: possiamo idratarci anche ingerendo altri liquidi.
Quasi la metà del nostro fabbisogno lo ricaviamo, inoltre, dall’acqua contenuta nei cibi.
4. Da dove proviene l’acqua terrestre, come si svolge il ciclo dell’acqua e perché è tanto difficile potabilizzare l’acqua di mare?

- Da dove proviene l’acqua terrestre?
Anche se non siamo certi al 100 per cento delle sue origini, è generalmente ritenuta una combinazione tra acqua proveniente dalla nube di materia primordiale dalla quale si è formata inizialmente la Terra e quella derivata in epoche successive da corpi celesti entrati in collisione con il nostro Pianeta.
Poiché noi siamo relativamente vicini al Sole, un po’ della nostra acqua originaria si è persa durante la genesi iniziale, ma oggetti più periferici, come gli asteroidi e le comete, potrebbero in effetti aver mantenuto intatte le proprie risorse liquide e rabboccato quelle terrestri, in seguito all’avvicinamento e all’impatto dovuti all’attrazione gravitazionale esercitata dal Sole.
Per lungo tempo si è ritenuto che un’elevata percentuale dell’acqua terrestre provenisse proprio da queste integrazioni tardive, ma ricerche più recenti hanno invece rivelato che l’acqua presente nella maggior parte delle comete e degli asteroidi tende a contenere una quantità maggiore di deuterio (un isotopo dell’idrogeno) rispetto a quella della Terra.
Questo suggerisce che molta della nostra acqua potrebbe risalire alle origini del Sistema Solare e che sarebbe stata “protetta”, nelle fasi iniziali di formazione della Terra, dalla sua collocazione ben al di sotto della superficie.
Risale infatti soltanto allo scorso anno la scoperta che rocce situate a una profondità di mille chilometri potrebbero fungere da veri e propri serbatoi. - Come si svolge il ciclo dell’acqua?
Grazie al flusso costante di energia fornito dal Sole, molecole di acqua evaporano dalle superfici marine e dai laghi (ma anche dalla vegetazione e dal terreno), raccogliendosi nell’aria.
Esse vengono poi trasportate dal vento in tutto il Pianeta.
Quando incontra correnti particolarmente fredde (ed è presente particolato intorno al quale le molecole possono condensarsi) il vapore acqueo forma delle goccioline che vanno a costituire le nubi.
Le goccioline si aggregano in gocce sempre più grandi fino a precipitare come pioggia. Quando piove su zone sopraelevate, l’acqua dilava verso il basso formando ruscelli e fiumi, fino a tornare negli oceani.
Questo ciclo è essenziale per gli organismi viventi che abitano la terraferma. - Perché è tanto difficile potabilizzare l’acqua di mare?
Viviamo in Italia, una penisola circondata dal mare: può sembrare assurdo che talvolta abbiamo problemi di reperimento di risorse idriche (ciò vale anche per molti altri Paesi, peninsulari o insulari).
Trasformare l’acqua salata in potabile è possibile, però è un processo costoso e ad alto dispendio energetico.
L’acqua di mare contiene una quota di minerali pari al 3,5 per cento del suo peso, per la maggior parte ioni di cloruro e sodio che, dopo l’evaporazione, formano il sale.
La tecnica di potabilizzazione più semplice consiste nella bollitura e raccolta del vapore allo stato puro.
In alternativa, è possibile separare idrogeno e ossigeno dall’acqua di mare mediante elettrolisi e poi ricombinarli per ricostituire il liquido; oppure, si possono rimuovere i sali minerali grazie a speciali membrane che consentono esclusivamente il passaggio di certe molecole.
Generalmente gli impianti di desalinizzazione industriali utilizzano varianti della tecnica di evaporazione: il processo è piuttosto semplice, ma richiede elevate quantità di energia per rimuovere le impurità, solitamente molto superiori a quelle necessarie per ricavare invece acqua da altre fonti, come le falde sotterranee o il riciclo.
5. Perché l’acqua non va sprecata, se sulla Terra ce n’è in abbondanza e che cosa non sappiamo ancora?

- Perché l’acqua non va sprecata, se sulla Terra ce n’è in abbondanza?
Oltre il 70 per cento della superficie terrestre è costituito da acqua, per un volume totale di 1,4 miliardi di chilometri cubici.
È una massa enorme, persino difficile da immaginare: un chilometro cubico corrisponde a un trilione di litri.
Se dividiamo questa quantità globale per il numero di abitanti, otterremo 0,2 chilometri cubici di acqua a testa.
Se pensiamo che un ragionevole consumo pro capite è di cinque litri al giorno, le risorse mondiali basterebbero per 116.219.178 anni, presumendo un vero e proprio “consumo”, quando invece sappiamo che l’acqua che utilizziamo diventa in breve tempo nuovamente disponibile per altri scopi.
Dunque, il problema della siccità è relativo, in effetti, alla difficoltà di approvvigionamento. Le risorse idriche si trovano talvolta nel posto sbagliato e devono essere trasferite.
O, ancora, è necessario eliminare qualche sostanza per garantire la potabilità: l’esempio più ovvio è quello dell’acqua di mare. - Che cosa non sappiamo ancora dell'acqua?
1) SENZA ACQUA PUÒ ESISTERE LA VITA?
Tutte le forme di vita terrestri hanno bisogno di acqua ma è possibile che altrove esistano organismi con una chimica e dei meccanismi vitali diversi.
Per esempio, sulla luna più grande di Saturno, Titano, sono presenti vasti oceani di metano ed etano liquidi, che potrebbero consentire la sopravvivenza di esseri alieni.
In ogni caso, continuiamo per convenzione a considerare l’acqua un indicatore della possibile presenza di vita, in quanto al momento è questa l’ipotesi più probabile.
2) QUANTE TIPOLOGIE DI GHIACCIO ESISTONO?
Il ghiaccio ha diverse forme cristalline (il numero esatto è ancora ignoto).
Il romanziere Kurt Vonnegut aveva immaginato, nella sua opera Ghiaccio Nove, una particolare forma di gelo già possibile a temperatura ambiente, che avrebbe determinato la solidificazione di mari e oceani.
Per fortuna, il ghiaccio IX non esiste in natura, ma è vero che sono state catalogate almeno 18 “fasi” solide i cui cristalli hanno strutture e conformazioni diverse.
Nel 2016 si è scoperto che anche l’acqua allo stato liquido ha due diversi stati e la temperatura in corrispondenza della quale avviene il passaggio è di circa 50°C.
3) PERCHÉ L’ACQUA CALDA CONGELA PIÙ RAPIDAMENTE DI QUELLA FREDDA?
Anche se noto da centinaia di anni, il fenomeno secondo il quale l’acqua a temperature superiori gela più velocemente dell’acqua fredda è stato denominato effetto Mpemba dal nome dello studente tanzaniano, Erasto Mpemba, che lo approfondì negli anni Sessanta.
Sono state suggerite diverse motivazioni, ma non è semplice dare una spiegazione univoca, data la difficoltà di preparare due campioni identici e stabilire poi con esattezza il momento del passaggio di stato.
Note
GLOSSARIO
- ELETTROLISI:
Il processo che consiste nel far passare un flusso elettrico attraverso un fluido, per indurre un elettrodo ad attirare ioni caricati positivamente e l’altro elettrodo ad attirare ioni caricati negativamente. - LEGAME A IDROGENO:
Attrazione che si instaura tra la carica elettrica positiva relativa di un atomo di idrogeno e la carica negativa relativa di un atomo, nel nostro caso, di ossigeno, rendendo la separazione delle molecole d’acqua più difficile di quanto ci aspetteremmo. - IONI:
Gli atomi sono elettricamente neutri, con pari numero di elettroni negativi e protoni positivi, ma possono perdere o acquistare elettroni. in tal caso, si chiamano ioni. - POLARIZZAZIONE:
Le onde luminose oscillano in direzione laterale durante il percorso di avanzamento della luce. Se questi movimenti avvengono tutti nella stessa direzione, allora la luce si dice polarizzata e questo fenomeno influisce sulla sua interazione con la materia. - CARICA ELETTRICA RELATIVA:
Benché gli atomi siano elettricamente neutri, quando idrogeno e ossigeno si legano formando acqua, la posizione degli elettroni varia, assegnando agli atomi, a tutti gli effetti, una carica. - SPETTROSCOPIA:
Quando la luce colpisce un atomo, viene in parte assorbita dai suoi elettroni. Ciascun elemento assorbe delle frequenze specifiche, che si manifestano come linee scure in uno spettro di luce bianca attraversato dalla luce.





