
Al grande fisico Ernest Rutherford è attribuita la celebre frase “Le uniche scienze sono fisica o filatelia”, con irritazione degli studiosi di altre discipline scientifiche delle generazioni successive.
Tuttavia, quando nel 1908 gli venne assegnato un premio Nobel per un esperimento di fisica, il riconoscimento fu per la chimica. Rutherford la prese con spirito, commentando sulla sua “trasmutazione istantanea da fisico a chimico”.
Rutherford svolse un ruolo fondamentale nella determinazione – che sarebbe proseguita nel corso del XX secolo – di una legge periodica che governa gli elementi chimici: oggi la nostra comprensione degli elementi si deve sia alla fisica che alla chimica.
La legge fu scoperta esattamente 145 anni fa, nel febbraio 1869, da Dmitrij Mendeleev e da altri chimici come lui. Anche se viene considerato un chimico, Mendeleev trascorse pochissimo tempo in laboratorio alla ricerca degli elementi.
Che cosa sia effettivamente un elemento è stato oggetto di un lungo dibattito, e in qualche misura è tuttora un problema aperto.
La tavola periodica degli elementi è familiare a tutti gli studenti del mondo, ma c’è voluto un secolo di progressi scientifici per completarla. Scopriamo insieme la sua scoperta e come essa rivoluzionò la scienza.
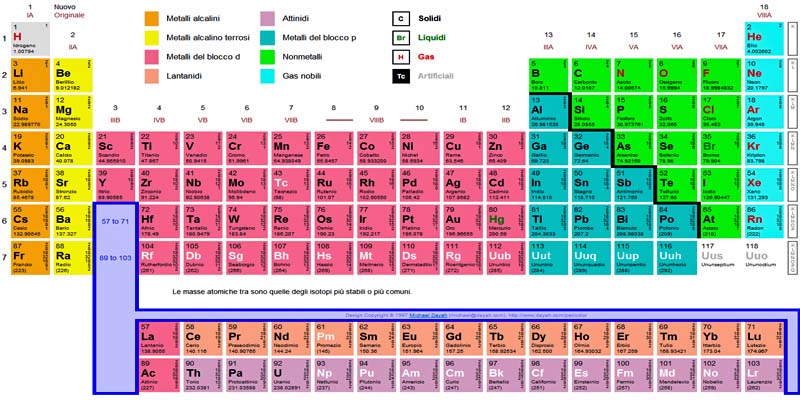
1. Materiali moderni
Il concetto di elemento risale agli antichi filosofi greci, che nel nostro mondo ne riconoscevano solo quattro: terra, acqua, aria e fuoco.
Gli elementi corrispondevano ai quattro solidi platonici studiati dai matematici: il cubo, l’icosaedro, l’ottaedro e il tetraedro.
Così la fluidità dell’acqua si riteneva dovuta alla forma relativamente poco spigolosa dell'icosaedro con le sue venti facce, mentre il dolore provocato dal contatto con il fuoco era spiegato dai vertici aguzzi del tetraedro.
Quando poi fu scoperto un quinto solido platonico, il dodecaedro con 12 facce, Aristotele propose l’esistenza di un quinto elemento: la "quintessenza”, l’etere dei cieli.
Ovviamente, alcune delle circa 90 sostanze che esistono in natura e che oggi riconosciamo come elementi erano giù ben note fin dall’antichità e anche da prima: per esempio, il carbonio, il rame, l’oro, il ferro, il piombo, il mercurio, l’argento, lo stagno e lo zolfo.
Queste sostanze si trovavano da sole, oppure erano facilmente separabili dai minerali in cui comparivano. Per diversi secoli, gli alchimisti si affaccendarono per cercare di trasformare i metalli "vili” che si trovano in natura, come per esempio il ferro e il piombo, in metalli "nobili”, come l’oro e l’argento, ma senza avere successo.
Nelle parole sprezzanti del filosofo Francesco Bacone, che scriveva poco dopo il 1620: "Tutta la filosofia della natura che abbiamo oggi è quella dei greci o l’altra, degli alchimisti. L'una riesce solo a moltiplicare le parole, l’altra non riesce mai a moltiplicare l’oro”.
Il concetto moderno di elemento chimico cominciò a emergere alla fine del XVIII secolo, a opera del chimico francese Antoine-Laurent de Lavoisier, che è considerato il fondatore della chimica moderna per il suo lavoro dal 1770 circa fino al 1794, anno in cui fu ghigliottinato.
Con esperimenti quantitativi, Lavoisier definì empiricamente un elemento come una sostanza materiale che non era stata ancora scomposta in sostanze più elementari. Nel 1789. anno della Rivoluzione francese, Lavoisier pubblicò il suo Traité elémentaire de chimie, in cui elencava 33 sostanze semplici, o elementi.
Molti di essi sono tuttora considerati tali: i gas idrogeno e ossigeno e i metalli noti fin dall’antichità, più il manganese, il molibdeno e il tungsteno, nonché i non metalli carbonio, zolfo e fosforo.
Tra gli altri presunti clementi chimici dell'elenco di Lavoisier, però, ci sono anche, la calce e la barite, che oggi sappiamo essere composti chimici, e la luce e il calore, che appartengono alla fisica, non alla chimica.
A ogni modo, Lavoisier escluse correttamente la terra, l’acqua, l’aria e il fuoco, dato che si era chiarito che erano composti da sostanze più fondamentali. Il passo successivo nella classificazione degli elementi fu compiuto da un chimico inglese, John Dalton, attorno al 1803.
Dalton ipotizzò che ogni elemento fosse costituito da un tipo specifico di atomo, che era un'entità indivisibile. Usando i dati di Lavoisier, Dalton stimò i pesi atomici di vari importanti elementi analizzando semplici composti chimici.
L’acqua sembrava formata per un ottavo del suo peso da idrogeno e per sette ottavi da ossigeno: così Dalton assegnò peso atomico 1 all’idrogeno e 7 all’ossigeno, assumendo che la formula molecolare dell'acqua fosse HO.
Anche se le proporzioni misurate da Lavoisier non erano del tutto precise e la formula molecolare di Dalton in questo specifico caso era errata (come ormai sanno tutti), il suo approccio era corretto.
I pesi atomici relativi degli elementi si sarebbero in futuro dimostrati cruciali, dopo ulteriori precisazioni, per riuscire a costruire poi la tavola periodica, nel corso degli anni Sessanta dell’Ottocento.
A cominciare fu un chimico tedesco. Johann Wolfgang Döbereiner, che per vari anni, a partire dal 1817, notò che terne di clementi con proprietà chimiche simili avevano anche delle somiglianze nei pesi atomici.
Per esempio, i metalli alcalini litio, sodio e potassio hanno pesi atomici rispettivamente 7, 23 e 39. Il peso atomico del sodio si trova quindi esattamente a metà tra quello del litio e quello del potassio (7 + 39 = 46: 46/2 = 23).
La stessa relazione vale per i metalli alcalino-terrosi calcio, stronzio e bario, e per gli alogeni cloro, bromo e iodio. Tra il 1827 e il 1858 altri chimici estesero le osservazioni di Döbereiner al di là di queste terne, aggiungendo il magnesio ai metalli alcalino-terrosi e il fluoro agli alogeni.
L’ossigeno, lo zolfo, il selenio e il tellurio furono classificati in una stessa famiglia; l’azoto, il fosforo, l’arsenico, l’antimonio e il bismuto in un'altra.

2. Approcci diversi

Nel 1858 un chimico italiano, Stanislao Cannizzaro, pubblicò un elenco standardizzato di pesi atomici e molecolari, riesumando un'ipotesi formulata nel 1811 dal suo connazionale, il chimico e fìsico Amedeo Avogadro, a proposito dei gas.
Avogadro, a differenza di Dalton, aveva intuito che i gas come l’idrogeno e l’ossigeno sono composti da molecole, a loro volta composte da atomi, e quindi il peso molecolare del gas doveva essere diverso dal peso atomico dell'elemento che lo costituisce.
Il peso molecolare dipende da quanti atomi dell’elemento sono contenuti nella molecola: nel caso dell'ossigeno, due. L’analisi di Cannizzaro fu alla base del dibattito nel corso del primo congresso Internazionale dei chimici, a Karlsruhe, in Germania, nel I860.
Tra i partecipanti ci furono Dmitrij Mendeleev dalla Russia, Julius Lothar Meyer dalla Germania e William Odling dalla Gran Bretagna.
Nel corso degli anni Sessanta del secolo, ognuno di questi chimici (come anche altri due, John Newlands e Gustavus Hinrichs e un geologo francese, Alexandre-Emile Béguyer de Chancourtois) propose una diversa versione della tavola periodica.
Studiarono le regolarità date dai pesi atomici, le proprietà chimiche e, nel caso di Hinrichs, gli spettri atomici dei 63 elementi noti all’epoca. La proposta di Mendeleev, concepita mentre scriveva un libro di testo di chimica, fu l'ultima delle sei.
Fu pubblicata in forma di bozza nel 1869 e in modo più compiuto nel 1871, ma non sembra molto influenzata dalle cinque proposte precedenti. Ognuna delle ipotesi aveva i suoi meriti, ma solo quella di Mendeleev prese piede.
La ragione principale del suo successo fu che tra il 1869 e 1871 Mendeleev aveva formulato numerose previsioni dell’esistenza di elementi ignoti, a cui diede nomi in cui usava la parola sanscrita eka, che significa “uno".
Tra essi c’erano l’eka-alluminio. l’eka-boro e l'eka-silicio, per i quali previde pesi atomici, rispettivamente, 68, 44 e 72. Il primo fu scoperto nel 1875 e battezzato gallio (peso atomico 69,7), il secondo, lo scandio, nel 1879 (peso atomico 45,0) e il terzo, che fu chiamato germanio, nel 1886 (peso atomico 72,6).
Mendeleev previde correttamente anche quasi tutte le proprietà chimiche dei nuovi clementi. Non tutte le sue previsioni ebbero lo stesso successo. Già prima della sua morte, avvenuta nel 1907, nuove scoperte misero in discussione la sua teoria.
Le versioni attuali della tavola periodica non rispettano tre principi cardinali cari a Mendeleev: la valenza, l'indivisibilità e l’immutabilità dell'atomo. La valenza è il numero di legami chimici che un atomo può formare con altri atomi.
Sembrava che i gas nobili (inerti) elio, neon, argon, cripton, radon e xenon - scoperti nell'ultimo decennio dell’Ottocento dal chimico William Ramsay e dal fisico Lord Rayleigh - fossero incapaci di reagire con altri elementi e che la loro valenza avesse il valore “proibito” zero; oggi sappiamo invece che alcuni di essi formano in effetti qualche composto.
La scoperta dell’elettrone nel 1897, dovuta al fisico J. J. Thomson, smentì invece l’indivisibilità: evidentemente l'atomo aveva una struttura interna.
La radioattività, infine, scoperta dal fisico Henri Becquerel nel 1896 e il cui nome fu coniato dai fisici e chimici Marie e Pierre Curie nel 1898, mostrò che la trasmutazione degli clementi in realtà può avvenire, attraverso il decadimento radioattivo che si verifica per elementi come l'uranio, il polonio e il radio.

3. Diamo i numeri

Il più serio di tutti i problemi, però, fu la fiducia incrollabile che Mendeleev riponeva nel valore crescente del peso atomico come principale criterio per l'ordinamento della sua tavola periodica.
Più era elevato il peso atomico di un elemento e più doveva comparire in posizione avanzata nella tavola, sosteneva Mendeleev.
Era conscio egli stesso delle difficoltà. perché ammise un paio di eccezioni alla regola: la principale riguardava il tellurio, che pose prima dello iodio, nonostante un peso atomico pari a 127,6 per il tellurio e 126,9 per lo iodio.
Giustificò questa inversione supponendo che il peso atomico di uno o entrambi gli elementi fosse stato determinato in modo erroneo. Ma il suo ragionamento si rivelò essere sbagliato.
Sebbene il tellurio abbia un peso atomico maggiore dello iodio, infatti, adesso sappiamo che il suo numero atomico, 52, è minore di quello dello iodio, 53. Il numero atomico era un concetto ignoto a Mendeleev. In alcune tavole periodiche del XIX secolo, gli elementi venivano semplicemente numerati in base al peso atomico crescente.
Questo concetto di numero atomico deve la sua esistenza ai fisici, e in particolare al lavoro compiuto da Rutherford e da Henry Moseley tra il 1911 e il 1914. Rutherford scoprì il nucleo atomico, dotato di protoni carichi positivamente, attorno a cui gli elettroni, con carica negativa, orbitano in una sorta di “sistema solare”.
Moseley seguì il suggerimento di un economista e fisico dilettante, Antonius van den Broek, secondo cui il numero di un elemento doveva corrispondere alla carica del suo nucleo, e cioè al suo numero di protoni.
Misurando le lunghezze d'onda delle linee spettrali caratteristiche nei raggi X di molti elementi, Moseley mostrò che queste lunghezze d’onda dipendevano in modo regolare dal numero atomico dell’elemento. E il numero atomico, non il peso atomico, il principio in base al quale vengono ordinate molte versioni della tavola periodica moderna.
Il motivo per cui il peso atomico dà ugualmente una buona indicazione delle proprietà di un elemento è che il peso atomico in genere va di pari passo con il numero atomico, perché il peso atomico è determinato dai protoni e dai neutroni del nucleo.
Al crescere del numero dei protoni, in generale, cresce anche quello dei neutroni. Quindi esiste una corrispondenza approssimativa tra il numero e il peso atomico. Ciò detto, la fisica dell’atomo non basta a prevedere il suo comportamento chimico come elemento.
Per citare Il sistema periodico, il celeberrimo volume di racconti che dobbiamo a Primo Levi, chimico ebreo sopravvissuto ad Auschwitz, “occorre diffidare del quasi- uguale”.
Persino il potassio e il sodio, due metalli alcalini vicini nella tavola periodica, possono comportarsi in modo molto diverso pur nella stessa situazione: uno provoca un’esplosione, l’altro no.
Alludendo a come scampò fortunosamente alla morte nel corso della Shoah, Levi aggiunge: “Le differenze possono essere piccole, ma portare a conseguenze radicalmente diverse, come gli aghi degli scambi” (dal racconto Potassio). Ed è una conclusione appropriata per la complessa vicenda della scoperta più significativa nella storia della chimica.
Nella foto sotto, Ernest Rutherford (a destra), qui nel suo laboratorio all’Università di Cambridge, ricevette nel 1908 il premio Nobel per la chimica. Il suo lavoro contribuì a far luce sulle regolarità della tavola periodica.

4. La scoperta chiave e tutta la cronologia

- La scoperta chiave
L’idea della tavola periodica venne a Mendeleev mentre scriveva un libro di testo che ebbe un grande successo.
Nel gennaio del 1869 aveva completato il primo volume, in cui però trattava solo otto dei 63 elementi noti all’epoca. Sapeva che per il secondo volume serviva un’organizzazione più strutturata, per poter soddisfare le scadenze e il formato richiesti dall’editore.
Quindi, il 17 febbraio 1869 (1o marzo del calendario gregoriano) si concentrò su come ordinare gli elementi, sia nel testo sia mentalmente.
Potrebbe aver giocato a un vero e proprio solitario con carte corrispondenti agli elementi; è pressoché certo che usò simultaneamente due metodi di classificazione.
Scrisse gli elementi in righe ordinate per peso atomico crescente, individuando cosi le ripetizioni periodiche delle proprietà chimiche, ed elencò in colonne vari “gruppi naturali", come i metalli alcalini e gli alogeni, individuando regolarità nella successione dei pesi atomici.
In questo modo, ottenne il cosiddetto "primo tentativo". L’elemento mancante era Se, lo scandio, ignoto nel 1869 ma scoperto poi nel 1879, con peso atomico 45.
Nella foto sotto, la prima tavola periodica di Dmitrij Mendeleev, compilata nel 1869, ordinava gli elementi noti per peso atomico crescente (numeri in piccolo). Nel 1879 fu scoperto lo scandio, l'elemento mancante nella tabella (nella riga in basso).

- Cronologia
Formano l'universo, ma c'è voluto quasi un secolo per scoprire e categorizzare gli elementi.
♦1817
In terne di elementi simili, come il cloro, il bromo (nell'immagine sotto) e lo iodio. Johann Wolfgang Döbereiner osserva che il peso atomico del secondo elemento si trova a metà strada tra il primo e il terzo.

♦1858
I pesi atomici sono standardizzati da Stanislao Cannizzaro (nell'immagine sotto), usando l'ipotesi di Amedeo Avogadro del 1811, secondo cui volumi uguali di gas ala stessa temperatura o pressione contengono numeri uguali.

♦1869
Dopo tentativi parzialmente riusciti da parte di vari chimici di trovare una periodicità nei pesi atomici degli elementi, Dmitrij Mendeleev (nell'immagine sotto), mentre scrive un libro di testo, introduce le basi per una tavola periodica corretta.

♦1875
I gallio, il primo dei tre elementi fino allora ignoti previsti da Mendeleev grazie ala sua tavola periodica, viene scoperto da Paul-Émile Lecoq de Boisbaudran (nell'immagine sotto). Lo scandio viene scoperto nel 1879, il germanio nel 1886.

♦1911
Bombardando lamine d’oro con particele alfa, Ernest Rutherford e i suoi collaboratori stabiliscono il modello nucleare dell'atomo. Antonius van den Broek (nell'immagine sotto) teorizza che la carica nucleare di un elemento determini il suo numero atomico.

♦1913
Esaminando gli spettri dei raggi X, Henry Moseley (nell'immagine sotto), dimostra che la carica del nucleo e il numero atomico sono connessi, le proprietà chimiche - e quindi la periodicità - sono determinate da questo numero ed esistono solo circa 90 elementi in natura.

5. I protagonisti

Le più grandi menti scientifiche degli ultimi due secoli hanno svelato l'ordine degli elementi.
- John Dalton (1766-1844).
Figlio di un povero tessitore di campagna e padre della moderna teoria atomica, era maestro di scuola a Manchester.
La sua affermazione che gli elementi chimici sono composti da atomi fu accolta da polemiche; nel 1803 compilò un elenco dei pesi atomici relativi, che comprendeva alcuni dei più importanti elementi noti.

- Johann Wolfgang Döbereiner (1780-1849).
Era un chimico tedesco che cominciò come apprendista in una farmacia.
Divenne professore all'Università di Jena, dove le sue lezioni furono seguite anche dal suo amico di lunga data Goethe.
Nel 1817 osservò una regolarità nei pesi atomici di terne di elementi con simili proprietà chimiche.
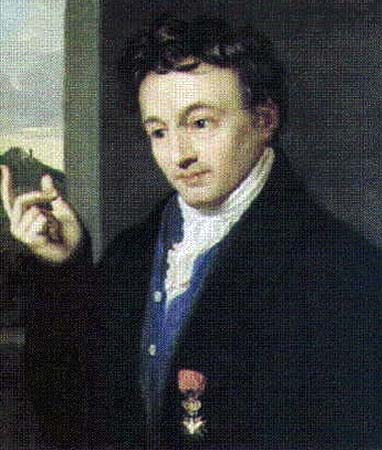
- Dmitrij Mendeleev (1834-1907).
Importantissimo scienziato russo, fu il più giovane di 14 figli.
Perse entrambi i genitori ancora adolescente, ma riuscì ad avere un’istruzione scientifica a San Pietroburgo, andò in Germania e poi tornò in Russia.
Analizzando pesi atomici e proprietà chimiche, mise a punto nel 1869 la sua tavola periodica.

- Ernest Rutherford (1871-1937).
E' probabilmente il più grande fisico moderno dopo Einstein.
Nato in Nuova Zelanda, svolse buona pane della sua attività scientifica in Gran Bretagna, a Manchester e a Cambridge, dove diresse il Cavendish Laboratory.
Nel corso del suo lavoro scoprì la struttura del nucleo atomico, che portò al concetto di numero atomico.

- Henry Moseley (1887-1915).
Fu un fisico inglese: dopo aver studiato con Rutherford a Manchester, tornò all’Università di Oxford nel 1913 per svolgere attività di ricerca.
Lì scopri la relazione fondamentale tra il numero atomico di un elemento e il suo com portamento chimico.
Fu ucciso dal proiettile di un cecchino a Gallipoli, nel corso della Prima guerra mondiale.

Note
GLOSSARIO
I termini necessari per capire la tavola periodica:
1. NUMERO ATOMICO
Il numero atomico di un elemento è il numero di protoni del nucleo dei suoi atomi. Il numero atomico dell'ossigeno è 8, quello dell’oro 79.
Molti elementi hanno forme diverse, dette isotopi, con lo stesso numero di protoni ma numeri diversi di neutroni. Il carbonio ha due isotopi stabili, il carbonio-12 (il più comune) e il carbonio-13, e un isotopo radioattivo, il carbonio-14.
2. PESO ATOMICO
Detto anche massa atomica relativa, il peso atomico di un elemento è il rapporto tra la massa media di un atomo dell’elemento e un dodicesimo della massa di un atomo di carbonio, che ha un peso atomico approssimativamente uguale a 12. Il peso atomico dell'ossigeno è 16. quello dell’oro 197.
3. ELEMENTO
Un elemento chimico, come l’ossigeno o l’oro, è una sostanza che non si può scomporre in altre più semplici con mezzi chimici. Gli atomi di un dato elemento hanno tutti lo stesso numero atomico. Elementi diversi hanno numeri atomici diversi.






