Come nasce un farmaco?
È un percorso lungo (dura fino a 8 anni) quello che porta una sostanza a diventare farmaco: da migliaia di composti candidati si arriva a una molecola che può curare una malattia o i suoi sintomi.
Servono molte conoscenze e tanta pazienza anche quando a “dettare le regole” è una pandemia: per testare e mettere in commercio il vaccino contro COVID-19 ci vorranno infatti almeno 12 mesi…
1. Porsi un obiettivo e caccia al candidato

Ogni anno sono oltre un milione e mezzo i farmaci studiati in laboratorio, ma poche decine escono promossi dai test sull’uomo, dopo un percorso che dura circa otto anni.
Una strada in salita perché sviluppare un nuovo farmaco è una sfida di fronte alla quale ci pone la complessa biologia del nostro organismo.
Conoscere bene i meccanismi di una malattia è la condizione ideale da cui partire, ma è quella meno frequente proprio a causa della nostra complessità biologica. Inoltre, siamo diversi l’uno dall’altro e non assorbiamo i farmaci nel medesimo modo.
Infine, abbiamo ottime barriere di difesa naturale contro le sostanze tossiche (farmaci compresi) ossia gli acidi dello stomaco, l’intestino, il fegato, i reni, le membrane che proteggono il cervello.
Il bersaglio di un farmaco è quasi sempre una proteina contenuta nelle nostre cellule: ce ne sono almeno 50mila nel nostro corpo, ma solo di poco più del 10 per cento conosciamo la forma in tre dimensioni che permette di fare simulazioni efficaci al computer durante le fasi iniziali di uno studio.
«Se consideriamo il farmaco come una sorta di chiave, la serratura sarà la proteina recettore», spiegano nel libro Come nascono le medicine – La scienza imperfetta dei farmaci (Zanichelli) Maurizio D’Incalci e Lisa Vozza, rispettivamente capo del dipartimento di oncologia dell’Istituto di ricerche farmacologiche Mario Negri di Milano e biologa e membro della direzione scientifica dell’Associazione italiana per la ricerca sul cancro.
«Alcuni farmaci si legano al recettore e causano una risposta, altri invece lo bloccano», aggiungono gli autori.
Una volta identificato il bersaglio, cioè la proteina, bisogna scegliere un composto possibile candidato a diventare il farmaco desiderato. La strada più veloce è valutare tutti i composti presenti in una collezione di sostanze, attingendo a vastissime banche dati con milioni di elementi, come quelle che possiedono, per esempio, le aziende farmaceutiche.
Per velocizzare questa valutazione vengono in aiuto gli analizzatori robotizzati e i software dedicati. Nei casi più fortunati possono bastare anche pochi giorni per ricavare almeno un composto candidato promettente, chiamato “guida” (lead in inglese) su cui lavorare.
Altre volte si sceglie invece il composto tra quelli già presenti in natura, sfruttando le particolari proprietà di qualche sostanza, di origine vegetale, minerale o animale.
Nella foto sotto, gli scienziati scelgono possibili farmaci candidati tra i composti presenti in banche dati a disposizione delle case farmaceutiche.

2. La sperimentazione, i test preclinici, in provetta e sugli animali

- La sperimentazione
A questo punto il candidato farmaco va testato e comincia la sperimentazione vera e propria, che si articola in diverse fasi e viene condotta prima in provetta e in modelli animali (sperimentazione preclinica) e poi sull’uomo (sperimentazione clinica).
L’obiettivo finale può essere verificare gli effetti di un nuovo farmaco oppure quelli di un farmaco già esistente ma che si vuole testare per un nuovo impiego terapeutico: è il caso, per esempio, di quanto sta accadendo in questi mesi con la sperimentazione di diversi farmaci per la cura di COVID-19, già presenti sul mercato per la terapia di altre patologie, ma che gli scienziati vogliono capire se possano funzionare anche contro la malattia che sta tenendo sotto scacco l’umanità.
- I test preclinici
Questa fase della sperimentazione serve a capire come si comporta il composto individuato e qual è il suo livello di tossicità su un organismo complesso: come deve essere somministrato, come viene assorbito e poi eliminato.
- In provetta
La sostanza viene messa in provetta ("in vitro") assieme a cellule malate prelevate dai pazienti o a microrganismi e sottoposta a una serie di test al microscopio, biochimici e genetici.
Serve anche testare la sostanza sulle cellule sane (controllo), che non dovrebbero subire effetti.
Per escludere che fattori indesiderati falsino i risultati, le cellule malate e quelle sane vengono inoltre sottoposte ai medesimi trattamenti ma senza il farmaco.

- Sugli animali
Soltanto quando si è appurato in provetta che il composto possiede potenziali effetti terapeutici, si può passare alla sperimentazione sugli animali (“in vivo”) per verificare se la sostanza sia efficace anche in modelli animali di malattie umane.
Questi studi, condotti rispettando le regole di un Comitato etico, forniscono inoltre dati preliminari sul comportamento della sostanza una volta che è stata introdotta nell’organismo vivente: come viene assorbita, come si distribuisce all’internodei tessuti, come viene metabolizzata ed escreta (eliminata).
Sono tutti dati che è necessario raccogliere per dimostrare l’effettiva sicurezza della sostanza prima di iniziare la sperimentazione nell’uomo: le statistiche dicono che solo una molecola su mille passa l’esame della fase preclinica per essere poi testata clinicamente sull’essere umano.
Ma gli animali in laboratorio sono necessari? In molti ambiti della ricerca medica non esistono metodi alternativi alla sperimentazione animale.
Tanti risultati che stiamo ottenendo nella lotta contro COVID-19 non sarebbero possibili senza gli animali di laboratorio, così come non sarebbe possibile sperimentare i farmaci oncologici.
La ricerca biomedica italiana utilizza, nei test su animali, per il 90 per cento roditori, per il 5 per cento pesci, per l’1-2 uccelli e a seguire conigli, suini, anfibi, equini, bovini e ovini, cani (0,04), primati non umani (0,03). I gatti non si usano più e nessun animale è usato nella ricerca cosmetica.
3. Lo studio sull’uomo: fase 1 e fase 2

- Fase 1
Con la fase 1 si fornisce una prima valutazione della sicurezza e della tollerabilità del medicinale.
Questi studi sono condotti in pochi centri selezionati su un numero limitato di volontari sani e che non devono essere predisposti a malattie.
L’obiettivo è valutare i potenziali effetti collaterali che ci possiamo aspettare in base ai risultati delle precedenti sperimentazioni sugli animali e come il farmaco agisce e si distribuisce nell’organismo.
I volontari “arruolati” vengono divisi in più gruppi, ciascuno dei quali riceve una diversa dose di farmaco, per valutare gli eventuali effetti indesiderati della sostanza in relazione alla quantità somministrata.
Se si sta sperimentando un farmaco per la cura di una grave malattia, questi studi possono essere condotti direttamente su pazienti che ne sono affetti e per i quali il farmaco è stato pensato.
Per i farmaci antitumorali, si conducono studi solo sui pazienti. Bisogna valutare il cosiddetto “profilo beneficio/rischio”: se il farmaco dimostra di avere un livello di tossicità accettabile rispetto al beneficio previsto, può passare alle fasi successive della sperimentazione.
- Fase 2
In questa fase, che dura circa un paio d’anni, si comincia a indagare l’attività del potenziale farmaco, cioè la sua capacità di produrre sull’organismo umano gli effetti curativi desiderati.
Inoltre si cerca di comprendere quale sarà la dose migliore da sperimentare nelle fasi successive e di determinare l’effetto del farmaco in relazione ad alcuni indicatori della salute del paziente (tollerabilità), come per esempio la pressione sanguigna.
La sostanza è somministrata a un centinaio o poche centinaia di soggetti volontari affetti dalla patologia per cui il farmaco è stato pensato.
I pazienti vengono di solito divisi in più gruppi, a ciascuno dei quali è somministrata una dose differente del farmaco e, quando eticamente possibile (senza mettere a rischio la salute), un placebo, cioè una sostanza priva di efficacia terapeutica.
Per evitare che la somministrazione del placebo influenzi le aspettative dei partecipanti, le valutazioni sono condotte senza che paziente (studio in cieco singolo) o medico e paziente (studio in doppio cieco) conoscano il tipo di trattamento ricevuto o somministrato.

4. Lo studio sull’uomo: fase 3 e fase 4
- Fase 3
Lo studio di fase 3 serve a determinare quanto è efficace il farmaco, se ha qualche beneficio in più rispetto a prodotti già in commercio e qual è il rapporto tra rischio e beneficio.
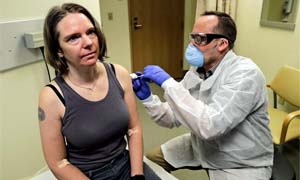
I pazienti “arruolati” sono centinaia o migliaia e provengono di solito da più ospedali (nella foto a sinistra, Jennifer Haller 43 anni, madre di due figlie e manager di un’azienda biotech, è la prima volontaria a cui è stato iniettato il vaccino sperimentale mRNA-1273 contro SARS-CoV-2, in fase 1di sviluppo in USA).
L’efficacia del farmaco sui sintomi, sulla qualità della vita o sulla sopravvivenza è confrontata con un placebo o con altri farmaci già in uso, se questi già esistono per la cura della patologia.
Gli studi più rigorosi misurano la sopravvivenza effettiva del paziente, quelli meno rigorosi misurano solo parametri collegabili alla sopravvivenza, come per esempio quelli biochimici del sangue.
La sperimentazione di riferimento in questa fase è lo studio clinico controllato randomizzato: ai pazienti viene assegnato casualmente il nuovo principio attivo o un farmaco di controllo (in genere il trattamento standard usato per la patologia oggetto della ricerca) ed è molto affidabile nel definire l’efficacia di un medicinale.
Infatti, l’attribuzione casuale del nuovo farmaco o del farmaco di controllo garantisce che i due gruppi siano simili per tutte le caratteristiche, salvo che per il medicinale assunto.
Alla fine sarà possibile attribuire ogni differenza nella salute dei partecipanti solo al trattamento e non a errori o al caso. Durante questa fase vengono controllate l'insorgenza, la frequenza e la gravità degli effetti indesiderati.
La durata della somministrazione del farmaco è in genere di alcuni mesi. Il periodo di monitoraggio degli effetti è invece spesso più lungo e in qualche caso arriva a 3-5 anni.
- Fase 4
Questa fase (della sorveglianza post marketing) è attuata dopo l’immissione in commercio del farmaco. Dura qualche anno e serve ad acquisire ulteriori informazioni, valutare le reazioni avverse più rare, che negli studi clinici non potevano emergere, ma che con l’uso di massa del nuovo farmaco possono diventare rilevabili.
- Le eccezioni nell’emergenza
Quando non ci sono alternative terapeutiche e un paziente è affetto da una malattia grave o rara, o è in pericolo di vita, i medici possono procedere all’“uso compassionevole” (in inglese, off label) di farmaci già presenti sul mercato ma progettati per altre patologie.
È quanto succede con la terapia di COVID-19. Il medico deve comunque chiedere l’autorizzazione al trattamento del paziente al Comitato Etico, un gruppo di diversi specialisti (medici e non), che la rilascia informando nel contempo AIFA (Agenzia italiana del farmaco), la quale disciplina tutto ciò che attiene ai farmaci: registrazione, autorizzazione al commercio, controllo.

5. Il plasma e i vaccini contro COVID-19

- Il plasma dei guariti può salvare la vita degli ammalati
Il plasma di un soggetto guarito da COVID-19, purché contenente una quantità sufficiente di anticorpi neutralizzanti, potrebbe curare altri soggetti ammalati che non sono riusciti a sviluppare nel proprio organismo un’adeguata risposta anticorpale.
Bisogna però essere sicuri che non vi siano problemi di incompatibilità e che il paziente donatore di plasma non sia portatore di altre malattie.
In uno studio pubblicato su JAMA, cinque pazienti con sintomi severi di COVID-19 e un’altissima e persistente carica virale sono stati trattati con plasma di pazienti convalescenti contenente anticorpi neutralizzanti, mostrando significativi miglioramenti clinici. I pochi studi controllati su questa terapia sono convincenti: si è visto che i soggetti ai quali è stato trasfuso il plasma di donatori guariti avevano un 20 per cento di riduzione della mortalità rispetto a quelli che non lo avevano ricevuto perché non disponibile.
- Contro COVID-19 sono due i vaccini in pole position
Ci sono già molte decine di candidati al vaccino contro SARS-CoV-2, che si prevede non sarà disponibile per la popolazione prima della prossima primavera, dovendo rispettare i tempi delle tre fasi di sperimentazione clinica. Tra gli studi in stadio di sviluppo più avanzato ci sono:
Il vaccino messo a punto dalla Advent-IRBM di Pomezia con lo Jenner Institute della Oxford University, che usa un virus vettore, ossia un adenovirus di scimmia già impiegato per un vaccino anti Ebola, per trasportare la proteina “spike” di SARS-CoV-2 modificata geneticamente per non attaccare le cellule ma stimolare comunque la produzione di anticorpi.
Il vaccino mRNA-1273 messo a punto negli USA dall’Istituto nazionale per le malattie infettive diretto da Anthony Fauci con l’azienda biotech Moderna. mRNA è l’acronimo di “acido ribonucleico messaggero”, molecola che istruisce le cellule a produrre proteine particolari, come quelle virali che poi innescano la risposta immunitaria, ma senza causare l’infezione.