L’esercito guardiano della nostra salute conta numerosi “soldati” – le cellule – diversi tra loro e altamente specializzati, ma in grado di svolgere le loro mansioni in perfetta sintonia.
A essi tocca il compito di proteggerci dagli attacchi degli organismi nocivi e ripararne i danni.
I test per ricercare gli anticorpi anti SARS-CoV-2 sono utili nelle indagini su larga scala o per tenere sotto controllo persone, come gli operatori sanitari, che sono state molto esposte al virus.
Ma i normali cittadini, che aspirano alla “patente di immunità”, resteranno delusi. In questo caso i test sono poco indicativi o addirittura fuorvianti.
Gli scienziati spiegano come funziona il sistema immunitario e quando (ma anche perché) servono i test sierologici.
1. Due compiti

A tutti noi è capitato di fare i conti con un’infiammazione: un ginocchio gonfio, l’ascesso a un dente, una scottatura.
Tutti, dunque, ne abbiamo un’idea o ci illudiamo di averla perché si tratta di un concetto molto più complesso di quanto immaginiamo.
L’infiammazione, infatti, è uno dei modi in cui il sistema immunitario, il nostro naturale sistema di protezione dalle malattie, esercita la sua funzione di difesa e riparazione dei tessuti.
In genere, abbiamo l’errata percezione che le manifestazioni infiammatorie siano un fenomeno locale: ci sfugge invece che siano sistemiche, a carico cioè dell’intero organismo. Quando abbiamo la febbre, per esempio, la attribuiamo più a una malattia che a un sistema di difesa messo in atto dal sistema immunitario.
Ancora, ci sfugge che la risposta infiammatoria possiede sistemi di controllo sofisticati: paragonandola a una potente automobile, l’infiammazione ha acceleratori e freni localizzati non solo a livello delle cellule dell’immunità o degli organi, ma anche del cervello, dunque del sistema nervoso centrale.
Ciò significa che c’è una stretta connessione fra cervello e sistema immunitario nel regolare la risposta infiammatoria: inizio, intensità e termine.
Il sistema immunitario ha due compiti fondamentali. Il primo è proteggerci da sostanze e cellule estranee nocive, per esempio batteri, virus e funghi, i cosiddetti microrganismi patogeni.
Perciò è spesso paragonato a un esercito, organizzato militarmente con gerarchie e specializzazioni, in cui tutti i componenti, localizzati in aree diverse dell’organismo, svolgono un compito definito e preciso.
Numerose e diverse tra loro, tanto che non sono ancora state identificate tutte, le cellule dell’immunità pattugliano senza sosta come soldati il nostro organismo. Sono i cosiddetti globuli bianchi o leucociti: un nome generico che comprende svariati tipi di cellule di difesa.
Fra queste i macrofagi, che si trovano negli organi e nei tessuti; i neutrofili, che circolano nel sangue; le cellule dendritiche, che come sentinelle danno l’allarme in presenza di un agente estraneo; i linfociti, divisi in B e T, due classi diverse, ciascuna con specifiche funzioni.
Perché questa varietà di cellule? Il nostro sistema di difesa si trova ad affrontare problemi differenti, dai grossi parassiti come i vermi intestinali ai piccoli virus invisibili perfino al microscopio contro i quali non è efficace utilizzare le stesse armi.
Riconoscimento e comunicazione sono le parole chiave alla base dei meccanismi di funzionamento del sistema immunitario. Riconoscimento perché è necessario saper distinguere fra microbi buoni e cattivi e individuare la presenza di nemici da aggredire, senza però danneggiare i componenti dell’organismo.
Comunicazione perché per fare questo è indispensabile un adeguato sistema di trasmissione delle informazioni». Il secondo compito del sistema immunitario consiste nel riparare i danni causati dagli agenti estranei e dalla risposta immunitaria stessa. Una risposta ai patogeni eccessiva o mal diretta, infatti, può danneggiare l’organismo e causare svariate malattie, da quelle autoimmuni ai tumori.
In questo senso possiamo paragonare il sistema immunitario a un’orchestra, con i direttori, i linfociti T, che sovrintendono all’armonico funzionamento degli orchestrali e degli strumenti, ovvero delle diverse cellule di difesa, che, pur con compiti distinti, lavorano tutte insieme per proteggerci nella maniera migliore.
2. Due tipi di immunità
Contro i microrganismi estranei, il sistema immunitario mette in funzione due linee fondamentali di difesa: l’immunità non specifica, o innata, e l’immunità adattativa, o acquisita.
L’immunità innata è la nostra prima linea contro le infezioni ed è basata su un particolare tipo di globuli bianchi, i fagociti.
Il loro nome (che deriva dal greco phagein, mangiare, e kytos, cellula) ne descrive perfettamente le caratteristiche: significa “cellule che mangiano”. I fagociti sono infatti capaci di inglobare molti agenti che causano malattie, neutralizzandoli.
Ogni giorno ne muoiono circa 100 milioni per tenere sotto controllo batteri e altri microbi: sono un po’ i “militi ignoti” del sistema immunitario, a lungo sottovalutati, se non quasi dimenticati, dalla ricerca immunologica.
I fagociti sono capaci di riconoscere l’allarme innescato dal danno ai tessuti. Ogni volta che ci feriamo o ci scottiamo, per esempio, dalle zone interessate vengono rilasciate particolari molecole che le cellule dell’immunità innata riconoscono come segnali di pericolo. Prende il via in questo modo la risposta infiammatoria.
Nella maggior parte dei casi l’immunità innata risolve i nostri problemi senza che neppure ce ne accorgiamo. Se però un agente infettivo riesce a superare quella resistenza, entra in gioco l’immunità acquisita, che produce una risposta immunologica specifica di cui l’organismo conserva memoria.
Ne sperimentiamo gli effetti ogni volta che ci sottoponiamo a una vaccinazione riguardante un determinato virus o batterio. Per cui se a distanza di tempo entriamo di nuovo in contatto con lo stesso agente infettivo, nella maggior parte dei casi risultiamo immuni e quindi protetti.
Questa linea di difesa così sofisticata ha come attori cellule specializzate: i linfociti T e B. Sono questi ultimi a produrre quelle specifiche armi di difesa dette anticorpi, che “si attaccano” al patogeno e consentono al sistema immunitario di distruggerlo.
I linfociti T, che si originano nel timo, sono invece i direttori dell’orchestra immunologica perché guidano il traffico delle cellule e delle molecole deputate a difenderci, indirizzandole nel luogo, nel momento e nella quantità giusti, garantendo il perfetto equilibrio del nostro organismo.
E quando veniamo a contatto con gli agenti microbici diventano gli strateghi delle nostre forze di difesa.
3. Quali test
Quanti italiani hanno contratto il SARS-CoV-2? Non è facile per ora dare una risposta, prima di tutto perché questo virus può non provocare sintomi e quindi molti di noi potrebbero averlo contratto senza saperlo.
La scienza però ci viene in aiuto con i test sierologici, che permettono di individuare nel siero, cioè nella parte liquida del sangue, la presenza di anticorpi specifici per SARS-CoV-2: i soggetti positivi a questi anticorpi sono sicuramente entrati in contatto con il virus perché il loro organismo ha sviluppato la risposta anticorpale che, tra l’altro, dovrebbe renderli immuni a successive infezioni da SARS-CoV-2.
Fin qui nella teoria. Ma come sempre, la pratica, ovvero la realtà, è assai più complessa. I test sierologici più affidabili sono condotti da un prelievo venoso di sangue e danno un risultato quantitativo, cioè quantificano gli anticorpi (immunoglobuline) IgM e IgG che il nostro organismo produce in risposta al virus in caso di infezione (vedi tabella sotto).
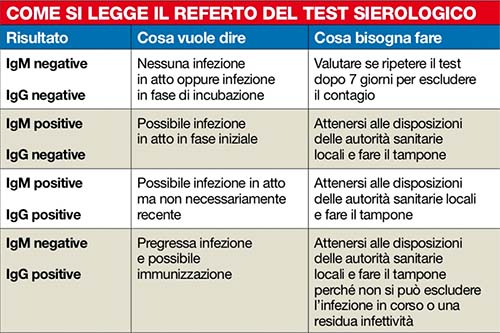
L’analisi richiede uno specifico strumento di laboratorio e il risultato arriva dopo alcune ore. Molto meno affidabili sono invece i test qualitativi, che si possono eseguire da soli con un kit portatile su una goccia di sangue capillare prelevato da un dito e che danno un risultato in pochi minuti, indicando la presenza o meno di anticorpi, senza quantificarli, secondo una logica positivo/negativo analoga al test di gravidanza che rileva l’ormone hCG nell’urina.
Di un test sierologico si valutano la sensibilità e la specificità. La sensibilità è la capacità del test di identificare in maniera corretta i casi positivi, cioè quelli che possiedono gli anticorpi contro SARS-CoV-2 perché sono venuti in contatto con il virus. La specificità di un test è invece la sua capacità di individuare i casi negativi che non hanno contratto il virus e non hanno quindi sviluppato gli anticorpi.
Pertanto, se la sensibilità è bassa, abbiamo più rischi di incorrere in falsi negativi (soggetti positivi ma risultati negativi al test anticorpale); se invece la specificità è bassa, abbiamo più rischi di incorrere in falsi positivi (soggetti negativi ma risultati positivi al test).
Un test, per esempio, con il 95 per cento di sensibilità e il 95 per cento di specificità darà rispettivamente il 5 per cento di falsi negativi e il 5 per cento di falsi positivi.
4. Testa o croce e quando servono i test sierologici?
Tuttavia, anche i migliori test sierologici quantitativi validati possono risultare fuorvianti se usati e interpretati in modo scorretto, al punto che la probabilità di conoscere la nostra reale condizione, dopo un test sierologico, potrebbe essere analoga a quella di ottenere testa o croce, lanciando una monetina.
È una questione statistica. L’affidabilità della risposta del test sierologico sul singolo soggetto dipende dalla prevalenza, cioè dalla diffusione, della malattia.
Se per esempio la malattia ha colpito solo l’1 per cento della popolazione (1 su 100) e il test sierologico ha una specificità del 96 per cento (dà l’errore di falso positivo 4 volte su 100), il rischio che il risultato sia sbagliato è molto alto poiché potremmo facilmente ricadere in uno dei 4 risultati errati.
Al contrario, se la malattia avesse colpito il 30 per cento della popolazione, il rischio che quel risultato sia un falso positivo sarebbe molto più basso.
Allo stato attuale della diffusione del contagio nella popolazione, pensare che un singolo cittadino possa effettuare un test sierologico per ricevere, in caso di esito positivo, una sorta di “patente di immunità”, non ha senso, perché non ci sarebbe la ragionevole certezza di essere davvero immuni sulla base dell’esito del test.
Dal calcolo statistico delle probabilità, per esempio, ricaviamo che un test positivo è probabilmente vero (99 per cento) se il 90 per cento della popolazione è immune, cioè ha contratto il virus.
Se invece è immune il 10 per cento della popolazione, la probabilità che il test positivo sia vero scende al 67 per cento e cala al 50 – come se lanciassimo una monetina – quando gli immuni nella popolazione sono il 5 per cento.
Ma se conduciamo le analisi sui grandi numeri, la statistica ci viene in aiuto e il test sierologico diventa un utilissimo strumento di indagine epidemiologica e per fare stime generali.
Inoltre, può essere molto utile per capire quanto si è diffuso il virus in gruppi ristretti (cluster) di popolazione molto esposti al contagio, per esempio tra gli operatori sanitari.
Se la prevalenza tra i medici è stata più alta rispetto al resto della popolazione, anche il dato sul singolo soggetto, all’interno di questo cluster, può essere significativo. Inoltre, il test sierologico condotto sugli operatori sanitari può limitare il ricorso ai tamponi e ottimizzare l’uso di risorse, come il consumo dei reagenti.
Per diagnosticare l’infezione attiva, infatti, l’unico strumento che abbiamo è il tampone naso-faringeo: l’operatore sanitario negativo al test anticorpale può essere controllato ogni settimana con il tampone, ma l’operatore positivo agli anticorpi, che ha già contratto il virus e presumibilmente sarà immune per qualche tempo, può essere sottoposto al tampone con cadenza più diradata, per esempio bimestrale.

5. Gli anticorpi ci proteggono?
L’uso corretto dei test sierologici e la loro ripetizione nel tempo potrebbe anche aiutarci a capire quanto dura l’immunità anticorpale nei confronti di SARS-CoV-2, un aspetto ancora molto discusso tra gli scienziati.
Affinché un soggetto sia immune al virus, deve avere un numero elevato di anticorpi neutralizzanti, che vengono prodotti in risposta al contagio, come dimostrato da solidi studi.
Ma non possiamo dire che ciò si verifichi sempre per tutti i pazienti, che gli anticorpi garantiscano sempre una buona protezione da successivi contatti con il virus e che siano sempre rilevabili dai test sierologici.
Sembra che la risposta anticorpale dipenda molto dall’andamento dell’infezione e sia inferiore nel paziente asintomatico rispetto a quello che ha avuto pochi sintomi o a chi li ha avuti gravi.
Di solito l’organismo produce le immunoglobuline IgM dopo 4-6 giorni dalla comparsa dei sintomi della malattia e dopo qualche settimana questi anticorpi scompaiono, mentre le IgG, prodotte al 9°-12° giorno dai primi sintomi, rimangono per un periodo più lungo, anche dopo che il paziente, ormai guarito, risulta negativo al tampone perché non ha più carica virale.
Ma in diversi pazienti COVID si è visto che le IgG compaiono insieme alle IgM. Potrebbe dipendere dal fatto che esiste nell’organismo una reattività incrociata con i quattro coronavirus più comuni che causano i raffreddori stagionali, nei confronti dei quali abbiamo una memoria immunitaria che ci permette di innescare la risposta delle IgG assieme a quella delle IgM.
Ne sapremo di più quando capiremo meglio cosa succede all’interno dei diversi tipi di cellule, per esempio i linfociti, durante l’aggressione di SARS-CoV-2. Ma perché tanti non vogliono fare il test sierologico?
Molte persone preferiscono non sottoporsi all’esame perché, in caso risultasse positivo cioè verificasse la presenza nel sangue di anticorpi per SARS- CoV-2, bisogna mettersi in isolamento domiciliare in attesa del tampone: l’unico modo per verificare di avere o meno l’infezione in corso.
Ma la gente non se la sente di restare ancora a casa. Ecco perché anche l’indagine sierologica nazionale avviata lo scorso 25 maggio dal Ministero della salute su un campione di 150mila cittadini selezionati dall’ISTAT ha registrato meno adesioni del previsto.
Note
6 PAROLE CHIAVE DA IMPARARE
- Antigene
Sostanza capace di provocare una reazione immunitaria specifica stimolando la produzione di anticorpi. L’organismo può entrare in contatto con un antigene in diversi modi: inalazione (pollini), ingestione (alimenti), iniezione (puntura di insetto) o contatto. Gli antigeni vengono inoltre introdotti nell’organismo per mezzo di iniezioni sottocutanee, trasfusioni e trapianti.
- Anticorpo
Prodotto dai linfociti B, è una proteina in grado di combinarsi con il corrispondente antigene. Ne esistono 5 differenti classi, ognuna con caratteristiche specifiche: IgA, IgD, IgE, IgG e IgM.
- Globuli bianchi
Cellule del sistema immunitario, definite anche leucociti: hanno il compito di difendere l’organismo. Sono classificati in 6 diverse tipologie, ciascuna con una specifica funzione: eosinofili, basofili, neutrofili, monociti, linfociti e cellule dendritiche.
- Immunizzazione
Processo grazie al quale un organismo acquisisce uno stato di immunità contro un determinato antigene.
- Malattie autoimmuni
Sono caratterizzate da un’aggressione del sistema immunitario che non riconosce i componenti dello stesso organismo di cui è parte: è il caso di artrite reumatoide, lupus eritematoso sistemico e sclerosi multipla.
- Vaccino
Preparazione usata per indurre una risposta immunitaria. È costituito da un microrganismo patogeno o da alcune sue parti o prodotti, trattati per renderlo incapace di causare malattia. Contiene in genere anche un adiuvante, cioè una sostanza in grado di stimolare maggiormente la risposta immunitaria a un antigene.






