Due recenti ricerche, pubblicate su Science, hanno gettato una nuova luce sul perché alcuni malati di Covid-19 sviluppano forme gravi, mentre in altri la malattia è lieve.
Secondo questi studi – a guida statunitense, ma con un’importante partecipazione italiana – alcune anomalie (o mutazioni) sul Dna sono all’origine delle manifestazioni più serie, assieme all’età e ad altri fattori di rischio già scoperti nei mesi scorsi.
Le mutazioni appena identificate mettono ko l’interferone, una molecola prodotta dal nostro organismo, che è una delle poche armi che il corpo può usare per contrastare il virus.
E anche se soltanto una parte dei pazienti presenta i difetti, le implicazioni sono importanti, come spiegano gli studiosi: «L’interferone esiste già come farmaco per altre malattie. I malati di Covid-19 potrebbero essere sottoposti a un’analisi genetica, e si potrebbe somministrare il medicinale nei casi in cui si scoprano le mutazioni».
Il sequenziamento del Dna umano fu un’impresa scientifica straordinaria che ha cambiato il volto della medicina. La sua storia fu una guerra senza esclusione di colpi fra due menti geniali e diverse. Scopriamola insieme.

1. IL LIBRO DELLA VITA, UN PROGETTO MOLTO AMBIZIOSO

L’approccio, insomma, è quello della farmacogenomica, che utilizza i farmaci in base alle caratteristiche genetiche dei singoli pazienti.
Impiegata ormai abitualmente nelle terapie contro i tumori, ma utile anche per altre malattie, la farmacogenomica è frutto delle conoscenze sul Dna che gli scienziati hanno acquisito nell’ultimo trentennio.
Più in particolare, è figlia del sequenziamento del genoma umano: la straordinaria impresa scientifica che riuscì per la prima volta a leggere i circa 3 miliardi di lettere che compongono il nostro Dna, e che determinano o influenzano le caratteristiche e le qualità che ci contraddistinguono.
Paragonato per importanza allo sbarco sulla Luna, il sequenziamento del genoma fu anche una guerra senza esclusione di colpi fra due menti geniali e profondamente diverse: Francis Collins, a capo del Progetto genoma, finanziato da fondi pubblici, e Craig Venter, lo scienziato-imprenditore che con la sua Celera Genomics sfidò apertamente il programma del rivale.

L’idea di decodificare il genoma umano si fece strada attorno alla metà degli anni Ottanta, in seno a due importanti istituzioni statunitensi: il Dipartimento dell’energia (Doe) e il National Institutes of Health (Nih), la massima autorità Usa in campo sanitario, che avrebbe poi preso la guida del progetto.
A una trentina d’anni dalla scoperta, da parte di James Watson e Francis Crick, della struttura a doppia elica del Dna, gli scienziati si erano infatti resi conto che la conoscenza accurata del genoma avrebbe fatto compiere alla medicina progressi importantissimi.
Inoltre, le tecniche già disponibili, seppur rudimentali rispetto a quelle moderne, avevano già permesso di decifrare i geni di alcune malattie, come la fibrosi cistica e la neurofibromatosi, entrambi scoperti con il contributo determinante di Francis Collins, che allora dirigeva un laboratorio all’Università del Michigan.
Nel 1990, Doe e Nih decisero quindi di avviare il Progetto genoma, che avrebbe dovuto completare il sequenziamento in 15 anni, con una spesa di 3 miliardi di dollari. La direzione fu affidata a James Watson, influente scienziato, il cui contributo nelle fasi preparatorie era stato determinante. Qui sotto, il premio Nobel James Watson.

2. FRANCIS COLLINS ALLA GUIDA DOPO UN INIZIO TORMENTATO

Watson stabilì di procedere per fasi. Il piano per il 1990-95 prevedeva di tracciare una prima mappatura grossolana del genoma, che sarebbe servita come base per il lavoro successivo, e di migliorare le tecniche di sequenziamento, che per rientrare nei tempi e nel budget dovevano essere più veloci e molto meno costose.
Alla sfida scientifica si aggiunse però una questione che parve subito spinosa: i dati ottenuti dal Progetto genoma sarebbero stati brevettati?
Nell’entusiasmo dell’inizio, il problema restò sotto traccia. Ma emerse con forza già nel 1992, quando la direttrice dei Nih, Bernardine Healy, si scontrò duramente con Watson proprio su questo punto.
In uno dei laboratori del progetto, diretto da un rampante scienziato di nome Craig Venter, si erano infatti ottenute delle sequenze, alle quali non era stato possibile attribuire alcuna funzione.
Healy e Venter avrebbero voluto brevettarle, ma Watson si oppose, sostenendo che la condivisione dei dati avrebbe permesso di accelerare gli studi e lo sviluppo di applicazioni utili. Lo scontro fu talmente duro che Watson alla fine si dimise, senza che la questione venisse risolta.
Intravedendo però un futuro incerto, anche Venter lasciò il progetto e fondò un istituto dal nome battagliero di Tigr (tigre, nella pronuncia inglese), acronimo di The Institute for Genomic Research.

Venter convinse a seguirlo alcune delle menti più brillanti del Progetto genoma, svuotandolo così di preziose competenze. Iniziò quindi a lavorare alla decifrazione del Dna di batteri, con la mente rivolta però al Dna umano.
Per circa un anno la poltrona di direttore del Progetto genoma rimase vacante. Nell’aprile del 1993, Healy chiamò infine Francis Collins (nella foto in alto a sinistra), che sulla questione dei brevetti chiarì presto la sua posizione: i dati ottenuti con fondi pubblici sarebbero stati a disposizione di tutti.
Del resto i tempi stavano cambiando, e diversi investitori avevano iniziato a finanziare piccole aziende centrate sulle possibili applicazioni degli studi sul Dna, che premevano per avere quei dati.
Sul versante scientifico, Collins sapeva che il Tigr aveva obiettivi che andavano ben al di là dei microbi. Era infatti evidente che, per affinare le tecniche, bisognava partire da esseri semplici, come appunto i microrganismi.
Per questo, il programma che lo scienziato presentò poco dopo il suo insediamento modificava in parte quello stabilito solo tre anni prima. Gli obiettivi principali (la prima mappatura e l’abbattimento dei costi) subivano poche variazioni.
Ma nel piano che avrebbe impegnato i ricercatori fino al 1998 si introduceva anche il sequenziamento del batterio Escherichia coli e del lievito Sacharomyces cerevisiae.
Parallelamente, Collins avviò programmi che avrebbero permesso, su periodi più lunghi, di decifrare anche i genomi della Drosophila melanogaster (il moscerino della frutta utilizzato come modello dai genetisti fin dall’inizio del XX secolo), di Caenorhabditis elegans (un verme che ha fornito molti spunti agli studi di genetica) e del topo, uno degli animali più utilizzati nei laboratori.
Qui sotto, Craig Venter espone uno schema della sequenza genetica da lui ottenuta, all’inizio del 2000.

3. BOTTA E RISPOSTA

Gli anni successivi furono segnati dal raggiungimento degli obiettivi, spesso in anticipo rispetto alla tabella di marcia.
Nel 1994 fu prodotta la prima mappatura, ma l’anno seguente Collins subì anche la prima cocente sconfitta.
Venter (nella foto accanto) annunciò infatti di aver ottenuto le sequenze di Haemophilus influenzae, un batterio che provoca la meningite, e di Mycoplasma genitalium, responsabile di infezioni del tratto urinario.
I risultati di Collins, insomma, erano sì importanti, ma parlavano agli addetti ai lavori. Svelando per la prima volta l’intero genoma di due esseri viventi, Venter guadagnava invece l’attenzione del mondo.
Il 1996 vide comunque una parziale rimonta di Collins: nel Progetto genoma entrò infatti massicciamente la britannica Wellcome Trust, che coordinava importanti laboratori nel Regno Unito, Germania, Francia, Giappone e Cina, e che iniziò a finanziare le ricerche sul Dna umano. Inoltre, i ricercatori del progetto pubblico centrarono un altro importante obiettivo, con la decifrazione del genoma del lievito.
Lo stesso anno però Venter calò un altro asso, sequenziando il Dna di Methanococcus jannaschii, un microrganismo marino capace di sopravvivere a pressioni che superano le 200 atmosfere e a temperature superiori ai 100 °C.
La scoperta non aveva applicazioni dirette sulla medicina, ma fece enorme scalpore fra i biologi, costringendoli a rivedere l’intera classificazione della vita sulla Terra. L’esame del Dna di Methanococcus jannaschii sanciva infatti l’esistenza di un tipo di microrganismi – gli archeobatteri – completamente diversi dai batteri già noti.

Le ricerche di Venter erano effettuate con una tecnica diversa rispetto a quella utilizzata dal Progetto genoma. Il metodo whole-genome-shotgun non si avvaleva di mappe preliminari, ma spezzettava l’intero Dna in minuscoli frammenti, che venivano decifrati e successivamente riassemblati con l’ausilio di potenti computer.
La tecnica era però mal vista dagli altri genetisti, e la sua accuratezza fu subito criticata. Tuttavia, i successi di Venter sembravano dimostrare che il sistema funzionava, almeno per genomi di dimensioni limitate come quelli dei batteri.
Parallelamente si affinavano anche le tecniche di Collins. Così, nel 1997, gli scienziati del Progetto genoma sequenziavano il Dna del batterio Escherichia coli e decifravano un gene coinvolto nel morbo di Parkinson in appena 9 giorni.
Il sorpasso sul piccolo gruppo rivale è però della fine dell’anno seguente, quando il consorzio pubblico ottenne la sequenza del Dna di un essere vivente ben più complesso di un batterio: il verme Caenorhabditis elegans.
Nel frattempo, Venter, che per un po’ aveva ripreso a collaborare con il Progetto genoma, aveva rotto nuovamente i rapporti con Collins, questa volta in modo definitivo. Venter fondò a Rockville (nel Maryland) la Celera Genomics e dichiarò che sarebbe riuscito a completare il sequenziamento del genoma umano entro 3 anni.
In pochi gli credettero. Ma Collins, che invece lo conosceva bene, non lo sottovalutò e decise di accelerare i tempi. Il suo piano, reso noto sulla rivista Science il 23 ottobre 1998, prevedeva di produrre una sequenza che avrebbe dovuto coprire il 90% del Dna entro il 2001, e di colmare i gap nei due anni successivi.
«Si tratta di un obiettivo molto ambizioso, visto che finora è stato sequenziato soltanto il 6% del genoma», ammetteva Collins che, senza citare apertamente la Celera, sottolineava che la tecnica usata dal gruppo rivale poteva «presentare grandi difficoltà nella fase di assemblaggio».

4. GENOMI, DIPLOMAZIA E UNA DATA DA RICORDARE

La storia dei due anni successivi fu segnata dai colpi di scena.
Nel settembre del 1999 Venter annunciò che la sua sequenza sarebbe stata pronta in pochi mesi, senza tuttavia fornire le prove di quanto affermava.
Collins rispose riscrivendo nuovamente la timeline (il nuovo obiettivo era il giugno del 2000), ma fece anche ricorso alla diplomazia.
Spalleggiato da diverse aziende farmaceutiche, che temevano almeno quanto lui che la Celera potesse sbarrare l’accesso ai dati con i brevetti, riuscì a ingraziarsi i politici. A metà marzo il presidente degli Stati Uniti, Bill Clinton, e il premier inglese, Tony Blair, dichiararono che i dati sul Dna umano dovevano essere pubblici.
I titoli azionari della Celera crollarono, ma risalirono poco dopo, quando Venter completò la sequenza della Drosophila melanogaster, uno degli esseri viventi su cui il Progetto genoma aveva puntato di più. Con quella mossa, lo scienziato dimostrava che il metodo da lui ideato funzionava anche per genomi più grandi e complessi di quelli dei batteri. Tutto era pronto per il gran finale.
Il 6 aprile del 2000 Venter dichiarava di avere in mano la sequenza del Dna di un essere umano; una sequenza in frammenti, che i suoi computer avrebbero assemblato nell’arco di poche settimane. Per i ricercatori che avevano dedicato anni della loro vita al Progetto genoma, sembrò la fine di un sogno. E il boccone si fece ancora più amaro quando Venter disse che la sequenza non sarebbe stata brevettata, ma messa a disposizione di tutti.

Incassato il colpo, Collins passò al contrattacco. In una serie di dichiarazioni di fuoco mise nuovamente sotto accusa la tecnica del rivale, invitò a diffidare delle sue dichiarazioni, e sottolineò che la Celera aveva ampiamente utilizzato i dati che il Progetto genoma aveva reso pubblici negli anni precedenti (cosa che Venter peraltro non negava).
Dietro le quinte, chiese però ai suoi ricercatori di lavorare a tappe forzate: le macchine dovevano essere sempre in funzione, i laboratori costantemente presidiati. La marcia ottenne il risultato sperato.
Il 26 giugno del 2000 i due protagonisti della battaglia furono accolti alla Casa Bianca, nella East Room affollata di diplomatici, scienziati e giornalisti di tutto il mondo. Assieme a Tony Blair, collegato in video da Londra, Bill Clinton annunciò che la prima sequenza del Dna umano era stata completata dai ricercatori del Progetto genoma e da quelli della Celera.
La stretta di mano fra Collins e Venter segnò la fine della guerra del genoma, ma non la rivalità fra i due. Qua sotto, la storica stretta di mano fra Venter (a sinistra) e Collins, il 26 giugno del 2000.

5. LE RICADUTE: DAI KIT ONLINE ALLA MEDICINA FORENSE

Dieci anni e 3 miliardi, contro poco più di un mese e un centinaio di euro. Sono le cifre che meglio rendono conto del balzo che i metodi di sequenziamento hanno fatto nell’ultimo ventennio.
Oggi chiunque può conoscere la propria sequenza genetica, collegandosi ai siti che offrono il servizio.
Sergio Pistoi, biologo molecolare, l’ha fatto qualche anno fa e ha poi raccontato la sua esperienza in libri di successo (l’ultimo, Dna Nation, non è stato ancora tradotto in italiano).
«La rapidità con cui si eseguono oggi i test, e i costi contenuti, hanno ricadute importanti sulla medicina, ma anche sulla società», spiega. «Milioni di persone in tutto il mondo hanno utilizzato i servizi online per i motivi più vari. I risultati non sono sempre accurati come quelli dei test che si eseguono in ambito medico, ma sono in grado di dire, per esempio, se si è predisposti a qualche malattia, oppure permettono di risalire alle proprie origini e scoprire lontani parenti, che vivono magari dall’altro capo del mondo».
Le ricadute del Progetto genoma, insomma, vanno ben oltre quanto gli stessi scienziati avevano immaginato. E un altro settore che ne ha beneficiato è quello della medicina forense: oggi è possibile risalire al colpevole, confrontando le sequenze del Dna prelevato da campioni presenti sulla scena del crimine con quelli di intere popolazioni, che si sottopongono al test.

Così, per esempio, è stato scoperto l’assassino di Yara Gambirasio, la tredicenne di Brembate di Sopra, uccisa nel 2010. A coordinare le analisi sul Dna fu il genetista Giuseppe Novelli, che racconta: «Il confronto fra il Dna rinvenuto sul cadavere e quello dei tanti cittadini che si sono sottoposti al sequenziamento ci ha permesso di risalire ai parenti dell’assassino, e poi al colpevole. Un’indagine di questo tipo non sarebbe stata possibile prima del Progetto genoma».
In ambito medico, poi, le nuove conoscenze hanno profondamente modificato le terapie antitumorali. «In molti casi, la farmacogenomica permette non solo di somministrare farmaci in modo personalizzato, ma anche di monitorare nel tempo l’esito delle terapie, senza ricorrere alle biopsie», dice Novelli.
«Nel campo delle malattie genetiche rare, infine, abbiamo oggi strumenti validissimi sia per individuare nuove sindromi, sia per eseguire le diagnosi, che un tempo erano molto più laboriose. Possiamo infatti confrontare il Dna di un paziente con quelli di riferimento depositati nei database pubblici, e identificare le anomalie genetiche che determinano la malattia».
Nella foto sotto, la preparazione di un campione di Dna per il sequenziamento.
Note
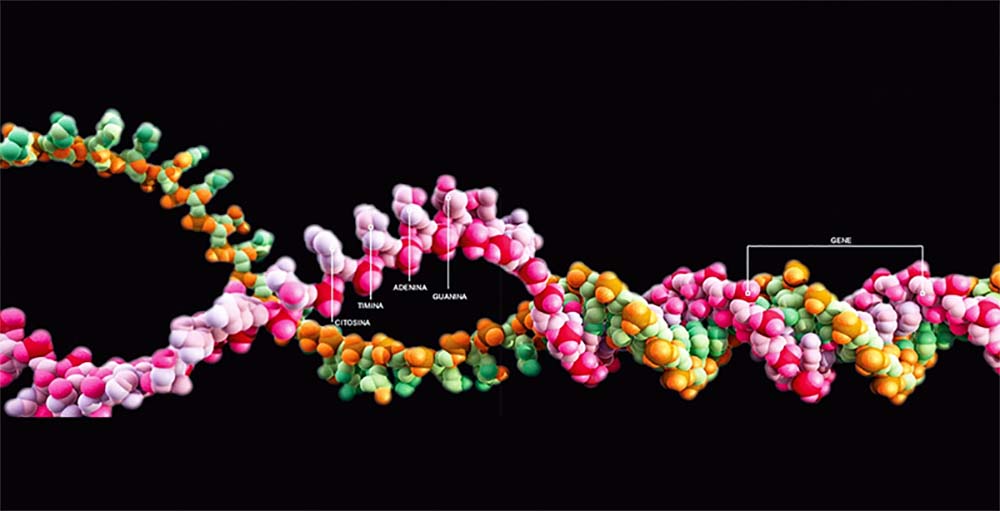
IL DNA
Il Dna è una lunga molecola presente nelle cellule, all’interno di uno scompartimento protetto e separato, chiamato nucleo. È spesso paragonato a un libro scritto in codice (il codice genetico), che descrive in modo molto accurato chi siamo. Le lettere del libro sono le basi, mentre i geni sono le parole. L’intero testo costituisce il genoma.
1. DOPPIA ELICA
Il Dna è costituito da due filamenti, che si intrecciano fra loro formando una doppia elica.
2. LE BASI
Su ciascun filamento si susseguono 4 tipi di gruppi chimici, chiamati basi.
3. I GENI
I geni sono segmenti lungo la molecola del Dna che, come le parole, hanno un senso compiuto. Essi determinano o influenzano le nostre caratteristiche.
4. IL GENOMA
L’insieme delle informazioni contenute nel Dna costituisce il genoma. Sequenziare il genoma significa leggere una dopo l’altra tutte le lettere (cioè, le basi) che lo formano.